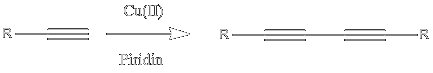Klikkelj ide!
Amikor K. Barry Sharpless, a 2001-es év kémiai Nobel-díjasa
publikálta click kémia néven ismert koncepcióját, nagy vitákat zúdított a kémikus
társadalomra. Egy olyan elképzelést publikált, amelyre keresve több mint 7500 találatot ad (alig 12 év termése) a SciFinder adatbázis. A „click reaction”-re
keresve pedig ez a szám majdnem 3000. Mi ez a fogalom, mi ez a koncepció, ez a „kémia”,
ami ilyen populárissá, publikálttá és ismertté vált alig több, mint 10 év alatt? És amelynek mások
magát a létezését, létjogosultságát is megkérdőjelezik.
 |
| Nézőpont kérdése? |
Úgy van a tudós társadalom a click kémiával mint a vak
indiánok a viccben az elefánttal, mindenki mást lát benne, attól függően, hogy
merről közelíti meg. Van aki rézkatalizált reakciók gyűjteményét látja benne
(mármint nem az elefántban, ennyire vak egy indián sem lehet J), van, aki enzimes biós izéket lát bele vagy egy új,
általános módszert polimerek előállítására, esetleg egy egészen új
metodológiát, melynek meg kell határoznia a szerves kémia jövőjét. A kritikusok
szerint pedig Sharpless pusztán egy új nevet adott a józan észnek, semmi újat
nem vezetett be.
 |
| Ilyen a kilátás egy Nobel-díjas irodájából...ööö...Itt láthatjátok Sharpless-t. |
Közhely, hogy a kémia olyan, mint a konyhaművészet. Nem csak
annyiban, hogy (távolról nézve) mindkettőben össze kell keverni bizonyos
mennyiséget az egyes összetevőkből, majd megfőzni/sütni kicsit, hanem abban is,
hogy (közelebbről nézve) az eredmény nem mindig úgy néz ki, ahogyan azt elképzeltük/a
receptkönyvben található:
Van, hogy „nem jön föl” a sütemény, vagy épp ellenkezőleg,
túlzottan felfújódik, de ami még talán ennél is gyakoribb tapasztalatunk (nem
feltétlen a konyhában), hogy ott van ugyan a várt termékünk, csak egy csomó
fekete „melléktermék” társaságában… Ismerős, ugye?! Állítólag ez volt az, ami
hősünket a click elképzelésre vezette, ami ráébresztette, hogy modern szintézismódszereink
kevéssé hatékonyak, távol járnak a józan észtől, és a természet szintézisstratégiájától,
aki pedig mégiscsak a „legnagyobb vegyész” (Marcinak…), tehát érdemes figyelni
rá.
Sharpless szerint a legnagyobb baj, hogy reakcióinknak kicsi
a termodinamikai hajtóereje, emiatt alacsony lesz a konverzió, extrém
körülményekre van szükség. A másik baj, hogy a modern szintetikus kémia főleg a
szén-szén kötések szintézisére fókuszál, amit nem tudunk elég hatékonyan (elég
nagy termodinamikai hajtóerővel) csinálni, szemben a természettel, „aki” ezt
főleg aldol kondenzációval csinálja. Azonban a molekulák nem csak szénvázból
állnak – mondja Sharpless – sőt, a nagy makromolekulák (nukleinsavak, fehérjék,
poliszacharidok, melyek az élet bámulatos sokszínűségét lehetővé teszik)
monomerjeiben nagyon ritkán található 6-nál több szén egymás után. Egyértelmű
hát a teendő, csináljuk azt, amiben jók vagyunk: szén-heteroatom kötésre fel! Vegyünk olyan alapmolekulákat, amiknek
készen van a szénváza, és olyan reakciókat hozzá, amelyeknek nagy a hajtóereje,
ezáltal enyhe körülményeket igényelnek, így nincs melléktermék képződés, bomlás
(lásd a fenti harmadik süti képe). Olyan egyszerű és hatékony lesz felépíteni
egy molekulát vagy egy molekulakönyvtárat, mint összeilleszteni LEGO kockákat
vagy összerakni egy IKEA asztalt. Így tényleg olyan reakcióink, olyan kémiánk
lesz, amilyet a természet „csinál”. Ésszerű, nem? Click, igen!

Amikor Sharpless ezt a koncepciót publikálta, egy példareakciót
is szolgáltatott, egy olyan reakciót, amely messzemenően teljesíti azokat a
kritériumokat, melyeket egy click reakciónak teljesítenie kell: nagy a
termodinamikai hajtóereje, emiatt enyhe körülményeket igényel, egyféle terméket
szolgáltat (tehát (sztereo)szelektív és nem igényel kromatográfiás tisztítást),
oldószer nélkül, vagy veszélytelen
oldószerben (elsősorban vízben) is végbemegy. Tehát „természetes”. Tehát zöld. Click.
 |
| A click reakció eredeti változatának sémája, ahol még két termék keletkezett |
 |
| A Cu(I) ionoknak köszönhetően már csak egyetlen termék keletkezik a click reakcióban |

A példareakció melyet azóta „a” click reakcióként (merthogy ne felejtsük, ez eredetileg egy gyűjtőnév) is
emlegetnek a CuAAC, vagyis a rézkatalizált azid-alkin cikloaddíció. A reakció
eredetileg több mint száz éves, és Huisgen nevéhez fűződik, azonban ebben az
eredeti változatában magas hőmérsékletet használtak a nagy aktiválási gát
leküzdésére, és a reakcióban termékelegy keletkezett attól függően, hogy hogyan
helyezkedett el a két reagáló komponens egymáshoz képest amikor koncertikusan összekapcsolódtak.
A termékelegy két izomert, az 1,4- illetve az 1,5-szubsztituált triazolt
tartalmazta. Sharpless csoportjának felfedezése az volt, hogy a réz(I)-ionok katalizálják
ezt a reakciót, alacsonyabb (akár szoba-) hőmérsékletet lehetővé téve, és ami
még fontosabb: a reakció az új mechanizmusnak köszönhetően szelektív lett: már
csak 1,4-diszubsztituált triazolok keletkeztek. (A réz(I)-ionok katalizálta reakciót
Sharpless csoportjával egyidejűleg, de tőlük függetlenül egy a Carlsberg
Laboratóriumban dolgozó kutatócsoport is felfedezte és publikálta.)
 |
| A Huisgen-cikloaddíció |
 |
| A click reakció (tádááááám) |
A reakció (egyszerűsített) mechanizmusa szerint a Cu+ koordinálja
mindkét reakciópartnert (az acetilénnel valójában sót képez), majd egy metallaciklus
jön létre (vagyis egy olyan gyűrűs vegyület, amely a gyűrűben tartalmazza a
fémet), ami utána gyűrűszűkülést szenved, majd megkapjuk a terméket és a
katalizátort; utóbbi ezután újabb katalitikus ciklusba „kezd” (merthogy tényleg
katalizátor, szemben pl. a Fiedel-Crafts reakciók Lewis-sav „katalizátoraival”,
melyek valójában aktivátorok, vagy ha úgy tetszik, reagensek). A mechanizmus
érdekessége a szokatlan Cu(III)-metallaciklusos köztitermék.
 |
| A click reakció egyszerűsített mechanizmusa |
A legegyszerűbb Cu(I)-ion források a Cu(I)-sók közvetlenalkalmazása,
vagy in situ előállítása. Utóbbi történhet in situ redukcióval Cu(II)-sókból
valamilyen alkalmas redukálószerrel (pl. C-vitamin vagy sója, a Na-aszkorbát (talán ez a leggyakrabban
használt katalizátorrendszer: réz-szulfát + nátrium-aszkorbát), merthogy az amit ma széleskörűen antioxidánsnak
szokás hívni, azt a kémia redukálószernek hívja), vagy szinproporcióval, ha a
Cu(II) ionok mellett egy rézdrótot is dugunk a reakcióelegybe, sőt, a Cu(II)
akár el is maradhat, úgyis ott van a rézdrót felszínén (patina). Érdekesség,
hogy több cikk szerzője nem is tudta, hogy valójában mivel katalizálja a
reakcióját, azt hitte Cu(0)-val vagy Cu(II)-vel, pedig valójában erre csak a
Cu(I) képes, ezekben az esetekben is ezt állította elő valamilyen jelen levő redukáló-
vagy oxidálószer (antiredukáns J) katalitikus mennyiségben. És ezeknél összetettebb
katalizátorrendszereket is kifejlesztettek, amelyek elsődleges célja a Cu(I)
ion stabilitásának és katalitikus aktivitásának növelése volt. Előbbi cél egyébként a feleslegben adagolt
redukálószerrel (Na-aszkorbát, ugyanis a Cu+-t az oxidációtól kell
megóvni, avagy „visszaredukálni”) is elérhető. Így a legkülönbözőbb komplexek
formájában használták a katalizáló iont, hordozóhoz is rögzítették: módosított
szilikagélhez, polimerekhez (ioncserélő gyantákhoz), „kopolimert” csináltak
belőle izonitrilekkel, de katalizálták a click reakciót a manapság divatos
nanorészecskékkel is (ki ne venne meg egy olyan cikket, amiben click és nano is
van a kulcsszavak között J).
A „hagyományos” (Cu(I)-só (elsősorban jodid), Cu(II)-só +
aszkorbát) réz(I)-ion forrásokon kívül a fent említettek közül két
szofisztikáltabb katalizátorrendszert próbáltunk ki saját praxisunkban: az
egyik egy ioncserélő gyanta (Amberlyst A21 a neve a kereskedelmi forgalomban),
amelynek a felületén dimetilaminobenzil csoportok vannak, amelyek megkötik a
Cu(I)-iont, ha CuI acetonitriles oldatában áztatjuk. Így egy igen aktív click katalizátor nyerhető. A másik esetben CuCl-ból és egy izonitrilből (2,4-dimetoxifenilizonitril)
polimert képeztünk, mellyel „on-water” körülmények között lehetett olyan click
reakciót is megvalósítani, ami más katalizátorral nem sikerült.
 |
| Amberlyst A21.CuI hordozós katalizátor "felületi szerkezete" |
 |
| Balról: 2,4-Dimetoxifenilizocianid képlete, jobbról: CuCl komplexe, mely tkp. egy lineáris polimer |
Egyes esetekben még bázist (Hünig-bázis, 2,6-lutidin,
aszkorbátion) is adnak a click reakcióhoz, hogy elősegítsék a mechanizmus első lépésében az acetilid képződését, ez azonban nem mindig szükséges.
A click reakció, vagyis a Huisgen-Sharpless-féle azid-alkin cikloaddíció fényes karriert futott be, a számos területeken – szerves, gyógyszer és analitikai kémia, anyag- és polimertudomány, biokémia, szupramolekuláris kémia – használták sikerrel. Előállítottak vele új gyógyszerjelölteket, molekulakönyvtárakat, dendrimereket, új funkcionális polimereket, analitikai eszközöket, valamilyen jelzőcsoporttal megjelölt biomolekulákat, ionofórokat (köztük kalixarén alapúakat J), egyéb receptormolekulákat (köztük nukleozid-polifoszfátokra érzékeny fluoreszcensz receptorokat J), szénhidrát-alapú konjugátumokat, peptidomimetikumokat és számos tudományos publikációt. J
Kifogásolható a katalizátor (réz(I)-ion) toxicitása, azonban ha ezt pl. szilárd hordozóhoz kötjük, akkor a hordozóval együtt eltávolítható (kiszűrhető, kiemelhető) a reakció végén a reaktoredényből. És akit ez sem nyugtat meg teljesen, azoknak a kedvéért van a reakciónak néhány olyan változata is, amelyekben elhagyható a Cu(I)ion katalizátor, ezekről a következő bejegyzésben fogok írni. Ekkor lesz szó kicsit részletesebben az alkalmazásokról is, amikeket most csak felsoroltam. És arról is, hogy melyik fém tud még valami hasonlót a Cu
+-hoz. No, és ne feledjük, a fentiekben csupán egyetlen példát hoztam a click filozófiára (bár az személyesen a click reakció volt). Vannak további hasonló reakciók, ezekről is lesz szó.
Legvégül pedig: hogy van-e különbség a józan ész és a click filozófia között (a sok impact faktoron kívül J)? Csak egy új nevet adtunk a hatékonyságnak? Ezt mindenki megítéli maga, ami azonban biztos, hogy a mai szerves kémia „sokminden, csak nem hatékony” (G. Whitesides, Harvard), ugyanis az előállított termékhalmaznak csak egy (kis) részét használjuk általában, ami megnehezíti a(z ipari) alkalmazást. Sharpless szerint a szintetikus szerves kémia 50-100 éve sokkal „click-ebb” volt, mint manapság, ugyanis éppen pl. a kevés rendelkezésre álló szofisztikált reakció, oldószer és tisztítási művelet miatt a vegyész csak abba az irányba tudott menni, amerre egy terméket kapott jó termeléssel, ami nem igényelt nagyon bonyolult tisztítást. Egy azonban biztos: a kémia egy alapvető fontosságú aspektusa kapott hangsúlyt, kitüntetett figyelmet Sharpless munkássága nyomán.